Por que ∆G = ∆H – T∆S é a equação mais importante em bioquímica
∆G = ∆H - T∆S é uma das fórmulas mais abstratas da ciência, mas também é uma das mais importantes. Sem ela, a vida não pode existir.
Crédito: ARTFULLY-79 / Adobe Stock
Principais conclusões- A bioquímica é o estudo das reações químicas biologicamente relevantes, principalmente aquelas envolvendo moléculas contendo carbono.
- '∆G = ∆H - T∆S' é a equação mais importante em bioquímica porque revela que reações químicas espontâneas — aquelas que ocorrem sozinhas sem intervenção externa — devem liberar energia livre (∆G).
- As células usam a energia livre liberada por reações químicas espontâneas para conduzir reações químicas não espontâneas, que requerem uma entrada de energia livre. Se as células não pudessem 'acoplar' as reações dessa maneira, a própria vida não seria possível.
A bioquímica é o estudo das reações químicas biologicamente relevantes – principalmente aquelas que envolvem compostos orgânicos (contendo carbono). Um dos principais temas da bioquímica é entender quais reações químicas ocorrem em organismos vivos e por quê. E a principal equação que descreve isso é: ∆G = ∆H – T∆S.
Em inglês, isso diz que a mudança de energia livre (G) é igual à variação de entalpia (H) menos temperatura (T) vezes a variação de entropia (S). Isso esclarece as coisas? Provavelmente não.
∆G = ∆H – T∆S
Para entender essa equação extremamente abstrata, vamos decompô-la. Sempre que há um delta (∆) , isso significa mudança. Por exemplo, se começamos com sete cookies e agora só restam dois, a mudança em (∆) cookies é -5. A razão pela qual medimos a mudança (∆) é porque o valor subjacente pode ser difícil, se não impossível, de medir. Com exceção da temperatura (T), nenhum dos outros termos pode ser medido diretamente. Só podemos medir as mudanças.
Energia livre (G) refere-se à energia que está disponível para realizar trabalho útil. Quando você executa seu laptop ou smartphone, a bateria não é capaz de fazer um trabalho útil com toda a energia armazenada. Como nós sabemos? Porque esses aparelhos eletrônicos esquentam. Isso não deveria acontecer em um mundo ideal; é energia desperdiçada. Mas não há nada que possamos fazer sobre isso porque não vivemos em um mundo ideal. (Mais sobre isso daqui a pouco.) Como resultado, a variação da energia livre (∆G) é sempre menor do que a quantidade total de energia que poderia ter sido extraída para o trabalho útil.
Entalpia (H) é um conceito um pouco estranho que os químicos inventaram para ajudá-los a entender as mudanças de energia durante as reações químicas. A mudança na entalpia (∆H) é essencialmente a mudança no calor. (É um pouco mais complicado do que isso, pois também inclui trabalho pressão-volume. Felizmente, isso geralmente é insignificante e pode ser ignorado.) As reações químicas absorvem calor (e se tornam mais frias ao toque) ou liberam calor (e se tornam mais quentes). ao toque), e a mudança na entalpia (∆H) mede isso.
T∆S , o termo final, representa o produto de temperatura (T) e a mudança na entropia (∆S) . Lembra daquele mundo ideal de baterias perfeitas em que não vivemos? A segunda lei da termodinâmica nos diz que a entropia (S, que pode ser pensada como desperdício de energia ou desordem ou caos) sempre aumenta no Universo. Você pode pensar na entropia como uma espécie de imposto que o Universo cobra por cada transferência de energia. T∆S, que representa a quantidade desse imposto, deve ser subtraído de ∆H.
Vamos tentar novamente reafirmar a equação ∆G = ∆H – T∆S em linguagem simples: A mudança na quantidade de energia disponível para realizar trabalho útil (∆G) é igual à mudança no calor (uma forma de transferência de energia) de um reação química (∆H) menos algum imposto ridículo que o Universo cobra (T∆S).
∆G determina se uma reação química pode ocorrer
Excelente. O que isso tem a ver com a vida? Que bom que você perguntou!
A vida é complexa e requer muitas reações químicas que não ocorrem espontaneamente. Uma reação espontânea ocorre sem intervenção. Se deixado por conta própria (ou seja, não há entrada de energia), a reação química ocorrerá por si só. Observe que isso tem nada fazer com velocidade. Uma reação espontânea pode ser muito rápida ou incrivelmente lenta. A corrosão devido à formação de ferrugem é espontânea, mas leva muito tempo.
Para que as células do seu corpo sobrevivam, elas precisam realizar reações espontâneas e não espontâneas. (Um exemplo de reação não espontânea é a construção de uma proteína.) A maneira pela qual uma célula pode realizar reações não espontâneas é acoplando uma reação espontânea (que é energeticamente favorável e libera energia livre) a uma reação não espontânea (que é energeticamente desfavorável e requer uma entrada de energia livre). Desde que o processo global resulte em uma liberação líquida de energia livre (por convenção, consideramos isso um valor negativo de ∆G), a reação pode prosseguir.
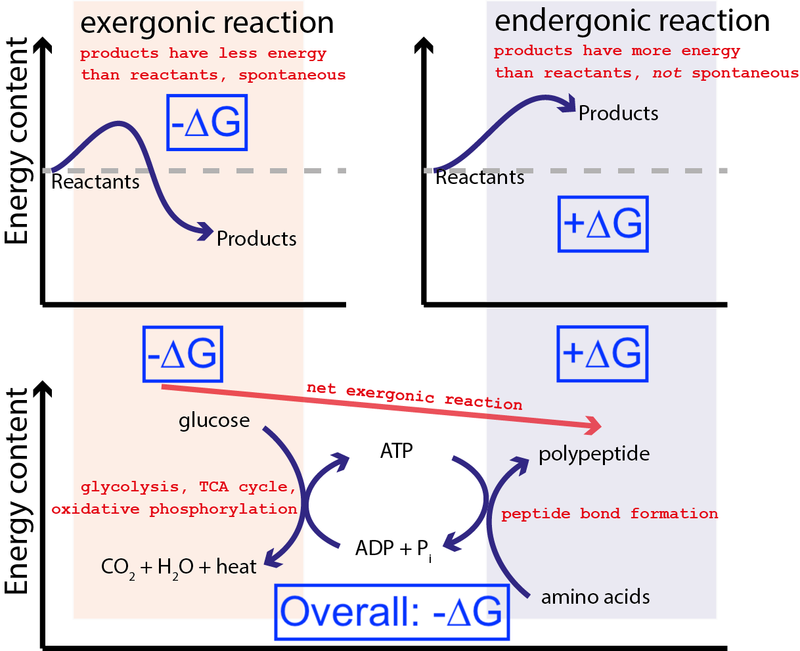
Crédito : Muessig / Wikimedia Commons via CC BY-SA 3.0 . Modificado pelo Big Think para incluir caixas azuis.
A figura acima mostra uma série muito típica de reações químicas em uma célula. Uma célula pode extrair energia livre da glicose (-∆G) para produzir uma molécula intermediária e altamente energética (chamada ATP ) que impulsiona a síntese de proteínas, que requer uma entrada de energia livre (+∆G). Como o processo geral tem uma liberação líquida de energia livre (-∆G), a reação pode prosseguir.
Se nossas células não tivessem a capacidade de conduzir reações químicas não espontâneas e energeticamente desfavoráveis (+∆G) usando reações químicas espontâneas e energeticamente favoráveis (–∆G), a vida não poderia existir . É por isso que ∆G = ∆H – T∆S é a equação mais importante em bioquímica.
Nota: Este é o fim do artigo. Mas os entusiastas hardcore da bioquímica podem se sentir à vontade para continuar lendo!
Materiais bônus:
∆G = ∆G°' + RT ln( [C][D] / [A][B])
Como geralmente é o caso, a ciência é realmente muito mais complicada do que isso. Considere uma reação química genérica da forma: A + B ⇌ C + D, onde A e B são reagentes e C e D são produtos. O atual equação mais importante em bioquímica é uma definição alternativa da mudança na energia livre (∆G):
∆G = ∆G°' + RT ln( [C][D] / [A][B])
Esta equação desafia uma explicação rápida e fácil, mas a essência geral é que a mudança na energia livre (∆G) depende da natureza inerente dos reagentes e produtos químicos (∆G°') mais uma constante (R) vezes a temperatura (T) vezes o logaritmo natural (ln) do produto das concentrações de C e D (isto é, [C] vezes [D]) dividido pelo produto das concentrações de A e B (isto é, [A] vezes [B]).
∆G°', conhecido como mudança de energia livre padrão em pH 7 , é um valor que é calculado quando todos os produtos (C e D) e reagentes (A e B) estão presentes inicialmente em uma concentração de 1 M (1 mol/litro) a 1 atmosfera de pressão a 25° C. Sob estes condições padrão — condições artificiais encontradas apenas dentro de um tubo de ensaio em um laboratório — a concentração dos reagentes ([A] e [B]) e dos produtos ([C] e [D]) sempre se estabilizará em valores muito específicos que dependem da natureza da reação química. O valor K'eqé uma constante que é única para cada reação química, e é calculada multiplicando a concentração final dos produtos ([C] vezes [D]), então dividindo pelo produto da concentração dos reagentes ([A] vezes [ B]).
PARA'eq= [C][D] / [A][B]
Porque K'eqé uma constante, R é uma constante e a temperatura (T) é definida como 25°C sob condições padrão (o que significa que também é uma constante), o valor ∆G°' é em si uma constante única para cada produto químico reação.
∆G°' = -RT ln(K'eq)
Mas fica ainda mais complicado. Se uma reação é espontânea ou não espontânea depende de ∆G, não de ∆G°’. As condições dentro de uma célula não são condições padrão. Os reagentes e produtos nunca estão na concentração de 1M (1 mol/litro) cada, e a temperatura não é 25°C. Portanto, calcular ∆G requer levar em conta essas considerações, e é assim que chegamos à fórmula mostrada acima :
∆G = ∆G°' + RT ln( [C][D] / [A][B])
Vamos tentar traduzir isso para o inglês: A mudança na energia livre disponível para realizar trabalho útil (∆G) é igual à mudança na energia livre que é característica dos reagentes e produtos específicos usados em condições artificiais de laboratório (∆G°') mais uma constante (R) vezes a temperatura real (T) vezes o logaritmo natural (ln) do produto das concentrações reais de C e D encontradas dentro de uma célula (ou seja, [C] real vezes [D] real) dividido pelo produto das concentrações reais de A e B encontradas dentro de uma célula (ou seja, real [A] vezes real [B]). Se depois de tudo isso ∆G for negativo, a reação é espontânea.
Neste artigo químicaCompartilhar:
















