Pergunte a Ethan: Como os campos magnéticos dividem os níveis de energia?
Se a luz não pode ser dobrada por campos elétricos ou magnéticos (e não pode), então como os efeitos Zeeman e Stark dividem os níveis de energia atômica?- Uma das coisas mais profundas que a física nos ensinou é que, dentro de cada átomo ou molécula, existe apenas um conjunto específico de níveis discretos de energia que seus elétrons podem ocupar.
- As transições entre esses níveis resultam em um espectro específico: um conjunto de linhas de absorção e emissão que sempre ocorrem exatamente nas mesmas energias e comprimentos de onda.
- Mas se você aplicar um campo magnético ou elétrico a esses mesmos átomos ou moléculas, esses níveis de energia se dividem, muitas vezes em muitos estados de energia superior e inferior. Como eles fazem isso?
Uma das coisas mais notáveis sobre a física é o quão universal ela é. Se você pegar a mesma espécie de núcleo atômico – com um número fixo de prótons e nêutrons – haverá apenas um conjunto fixo de níveis de energia que os elétrons que orbitam esse núcleo podem ocupar. À medida que os elétrons transitam entre os vários níveis de energia, eles emitem (à medida que caem para níveis de energia mais baixos) e absorvem (à medida que sobem para níveis de energia mais altos) fótons de um comprimento de onda e energia muito específicos: apenas os comprimentos de onda e energias permitidos pelas regras da mecânica quântica. Os valores para esses níveis de energia são universais: os mesmos para todos os átomos da mesma espécie em todos os lugares e em todos os momentos do Universo.
Até que você aplique um campo elétrico ou magnético externo. De repente, esses níveis de energia se dividem e assumem uma grande variedade de valores, com a quantidade de divisão dependendo inteiramente da intensidade do campo aplicado. Mas como isso é possível? É isso que Jon Coal quer saber, perguntando:
“Ei, você já fez um artigo sobre o efeito Zeemen? […] Acho que o que estou tentando entender é que, teoricamente, a luz não pode ser curvada por um campo magnético ou elétrico. Então, esses efeitos, Zeeman e Stark, estão modificando a estrutura atômica [em si]?”
O efeito Zeeman é o que vemos quando aplicamos um campo magnético externo, e o efeito forte é o que vemos quando aplicamos um campo elétrico externo. Ambos realmente dividem os níveis de energia atômica, mas não da maneira que você poderia esperar.
 Embora normalmente concebamos átomos como núcleos com elétrons orbitando-os, se o ambiente no qual um átomo é colocado tiver um campo magnético ou elétrico dentro dele, as propriedades orbitais dos elétrons, incluindo os níveis de energia que eles ocupam, mudarão. Como resultado, os fótons que eles emitem ou absorvem terão comprimentos de onda diferentes do que se o campo fosse removido.
Embora normalmente concebamos átomos como núcleos com elétrons orbitando-os, se o ambiente no qual um átomo é colocado tiver um campo magnético ou elétrico dentro dele, as propriedades orbitais dos elétrons, incluindo os níveis de energia que eles ocupam, mudarão. Como resultado, os fótons que eles emitem ou absorvem terão comprimentos de onda diferentes do que se o campo fosse removido.Em primeiro lugar, é verdade: a luz, apesar de ser uma onda eletromagnética em si, não pode ser curvada por um campo magnético ou elétrico. Os campos elétricos e magnéticos, notoriamente, fazem com que as partículas em movimento se dobrem, mas apenas se essas próprias partículas forem compostas de cargas elétricas diferentes de zero.
- Um próton pode ser dobrado por: um próton estacionário ou em movimento será acelerado na direção de um campo elétrico externo e um próton em movimento será acelerado em uma direção perpendicular ao seu movimento e à direção do campo elétrico aplicado campo magnético.
- Um elétron pode ser dobrado por: um elétron que está estacionário ou em movimento será acelerado na direção oposta à direção de um campo elétrico externo e um elétron em movimento será acelerado em uma direção que é mutuamente perpendicular tanto ao seu movimento quanto à direção de o campo magnético aplicado.
- Um nêutron não pode ser dobrado por um campo elétrico, porque é eletricamente neutro, mas ainda responderá a um campo magnético aplicado porque é inerentemente composto de quarks: partículas carregadas que se movem dentro dele. O nêutron tem um momento magnético intrínseco que é quase duas vezes mais forte que o do elétron e será afetado por um campo magnético externo.
Mas um fóton é descarregado e não é feito de constituintes carregados. Enquanto campos magnéticos e elétricos externos pode polarizar essa luz , mudando a direção de seus campos enquanto se propaga, eles não podem dobrar a própria luz.
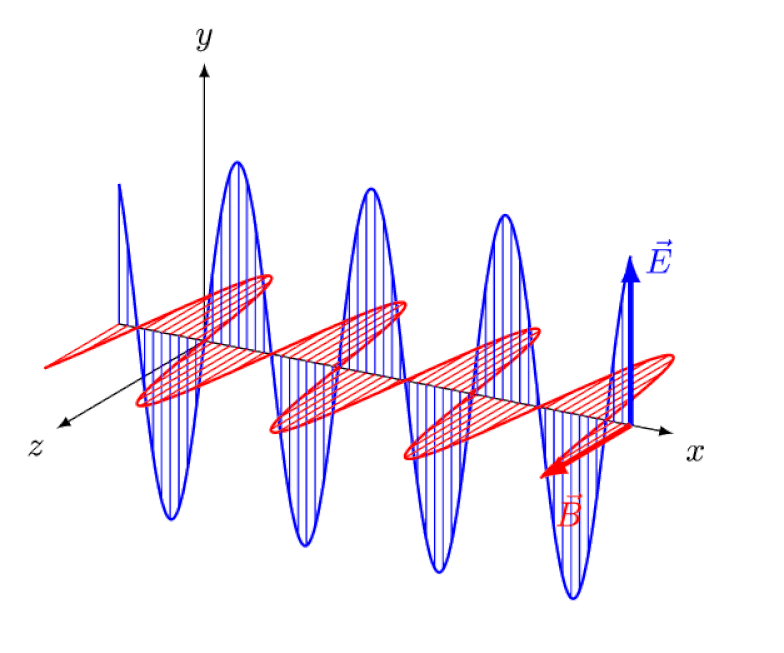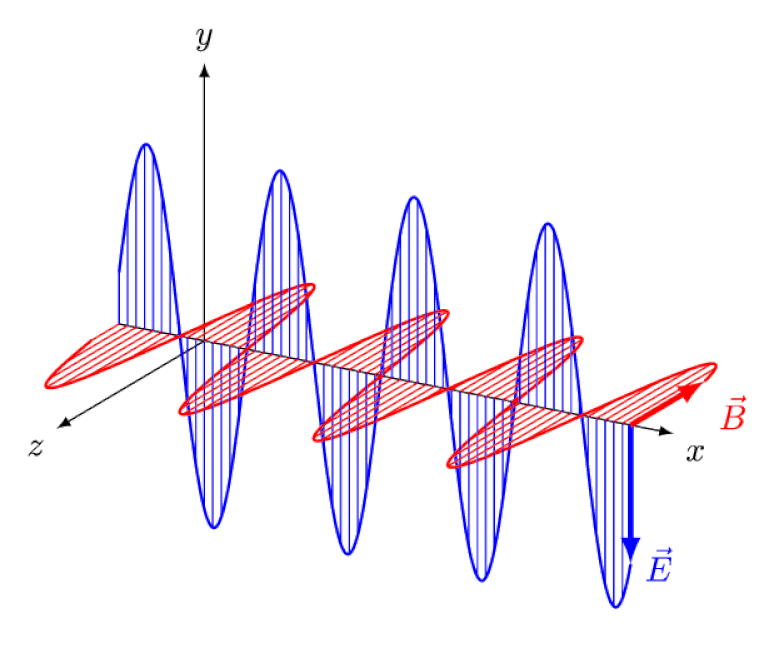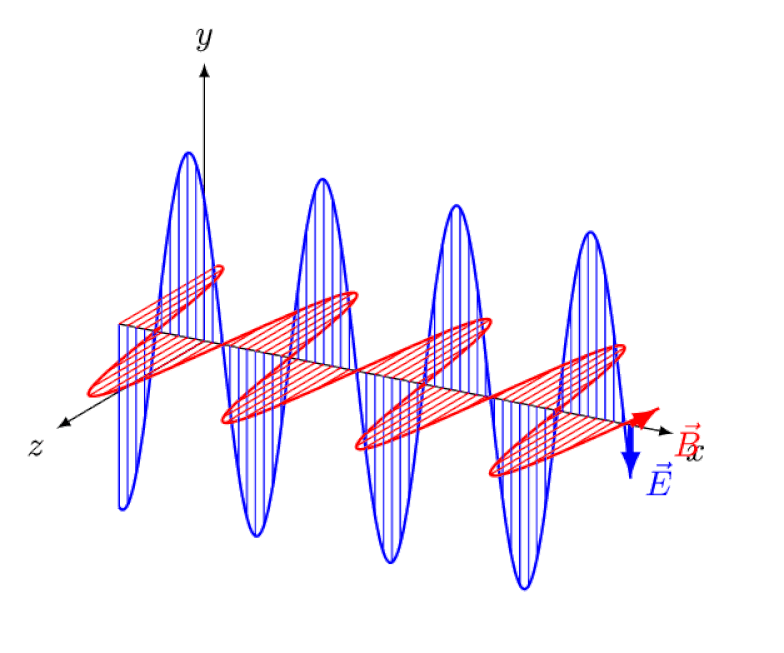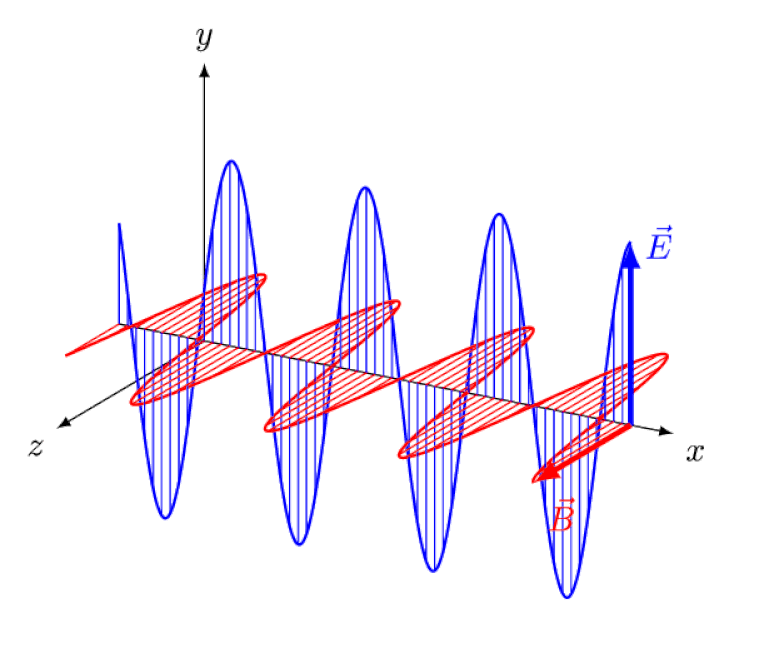 A luz nada mais é do que uma onda eletromagnética, com campos elétricos e magnéticos oscilantes em fase perpendiculares à direção de propagação da luz. Quanto menor o comprimento de onda, mais energético o fóton, mas mais suscetível a mudanças na velocidade da luz através de um meio.
A luz nada mais é do que uma onda eletromagnética, com campos elétricos e magnéticos oscilantes em fase perpendiculares à direção de propagação da luz. Quanto menor o comprimento de onda, mais energético o fóton, mas mais suscetível a mudanças na velocidade da luz através de um meio.Mas o efeito Zeeman e o efeito Stark não são apenas reais, mas ambos foram observados experimentalmente há muito tempo. O desafio para os teóricos não é demonstrar quais efeitos não podem estar em jogo – o que mostra o fato de que os fótons não podem ser desviados por campos elétricos ou magnéticos – mas sim descobrir a causa crítica do efeito observado, explicando sua magnitude e as condições em que aparece.
A confusão surge aqui porque não é porque os átomos emitem luz e então essa luz se propaga por uma região onde existe um campo elétrico ou magnético; essa é uma maneira de obter polarização, mas não uma maneira de obter a divisão dos níveis de energia, como no efeito Zeeman ou no efeito Stark.
Em vez disso, a maneira como você divide os níveis de energia dentro de um átomo (ou uma molécula, se preferir uma química mais complexa) é aplicando o campo elétrico ou magnético ao próprio átomo (ou molécula), antes da transição crítica de um nível de energia para outra ocorre. Esses fótons são criados dentro de um átomo ou molécula que já tinha esse campo externo aplicado a eles, e é aí que ocorre essa divisão. Deveríamos ter esperado, porque há uma maneira sutil de capturar o mesmo efeito subjacente que ocorre na natureza, mesmo sem um campo externo: por meio da fina estrutura dos átomos.
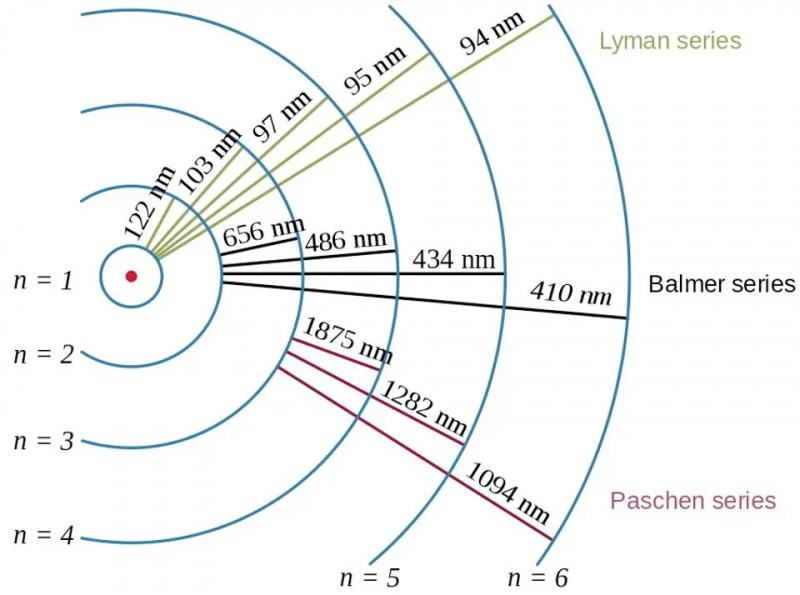 As transições de elétrons no átomo de hidrogênio, juntamente com os comprimentos de onda dos fótons resultantes, mostram o efeito da energia de ligação e a relação entre o elétron e o próton na física quântica. O modelo de Bohr do átomo fornece a estrutura grosseira (ou grosseira, ou bruta) dos níveis de energia, mas isso já era insuficiente para descrever a estrutura fina e hiperfina, que havia sido vista décadas antes.
As transições de elétrons no átomo de hidrogênio, juntamente com os comprimentos de onda dos fótons resultantes, mostram o efeito da energia de ligação e a relação entre o elétron e o próton na física quântica. O modelo de Bohr do átomo fornece a estrutura grosseira (ou grosseira, ou bruta) dos níveis de energia, mas isso já era insuficiente para descrever a estrutura fina e hiperfina, que havia sido vista décadas antes.A maioria de nós, quando pensamos nos níveis de energia dos átomos, remonta ao modelo de Bohr, que em si foi revolucionário. Em 1912, Bohr postulou que os elétrons não orbitam exatamente em torno do núcleo de um átomo da mesma forma que os planetas orbitam o Sol: mantidos no lugar por meio de uma força central invisível. Em vez disso, afirmava a ideia de Bohr, havia apenas certos estados particulares nos quais os elétrons podiam orbitar: orbitais, em oposição a possuir qualquer combinação de velocidade e raio que levasse a uma órbita estável no caso do movimento planetário.
Bohr reconheceu que o elétron e o núcleo eram ambos muito pequenos, tinham cargas opostas e sabia que o núcleo tinha praticamente toda a massa. Sua contribuição inovadora foi entender que os elétrons só podem ocupar certos níveis de energia, que é onde o termo “orbitais atômicos” veio pela primeira vez.
Os elétrons podem orbitar o núcleo apenas com propriedades particulares, levando às linhas de absorção e emissão características de cada átomo individual: o átomo de Bohr. Mas, embora seja assim que normalmente imaginamos os átomos hoje, em 1912, quando Bohr o propôs pela primeira vez, sabíamos que não poderia ser a história completa.
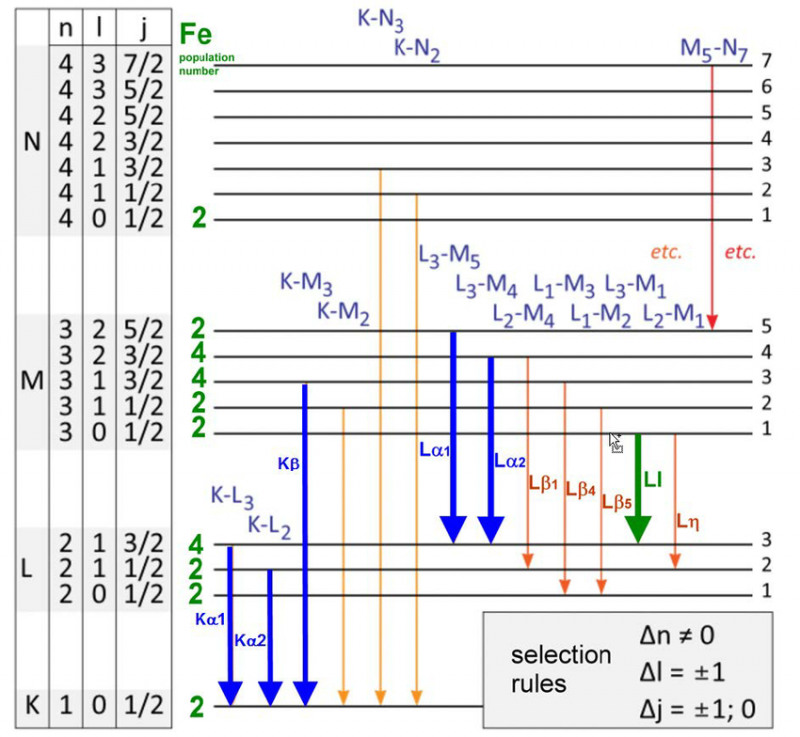 Uma variedade de níveis de energia e regras de seleção para transições de elétrons em um átomo de ferro. Há apenas um conjunto específico de comprimentos de onda que podem ser emitidos ou absorvidos por qualquer átomo, molécula ou rede cristalina. Embora cada átomo tenha um espectro único de energias, todos os átomos compartilham certas propriedades quânticas.
Uma variedade de níveis de energia e regras de seleção para transições de elétrons em um átomo de ferro. Há apenas um conjunto específico de comprimentos de onda que podem ser emitidos ou absorvidos por qualquer átomo, molécula ou rede cristalina. Embora cada átomo tenha um espectro único de energias, todos os átomos compartilham certas propriedades quânticas.Em 1887, quando Michelson e Morely estavam construindo e realizando seu famoso experimento que refutaria a necessidade de um éter, ou um meio em repouso em algum quadro de referência particular para a luz viajar, eles estavam estudando muito de perto a emissão e absorção propriedades do átomo de hidrogênio. Eis que esses resultados, já com 25 anos quando o átomo de Bohr foi proposto pela primeira vez, já estavam em conflito com as previsões do modelo de Bohr.
O modelo de Bohr, por exemplo, previu que o 2º nível de energia do hidrogênio seria o primeiro estado excitado que teria ambos
- orbitais s (capazes de conter 2 elétrons)
- e orbitais p (capazes de conter 6 elétrons)
produziria as mesmas energias para todas as 8 configurações eletrônicas possíveis. Mas os resultados de Michelson e Morely demonstraram pequenos desvios do valor de Bohr e também vários estados adicionais. Embora o afastamento do modelo de Bohr tenha sido pequeno, foi significativo, com a diferença mais impressionante sendo que alguns níveis de energia pareciam se dividir em dois, enquanto o modelo de Bohr possuía apenas um estado de energia que eles podiam ocupar.
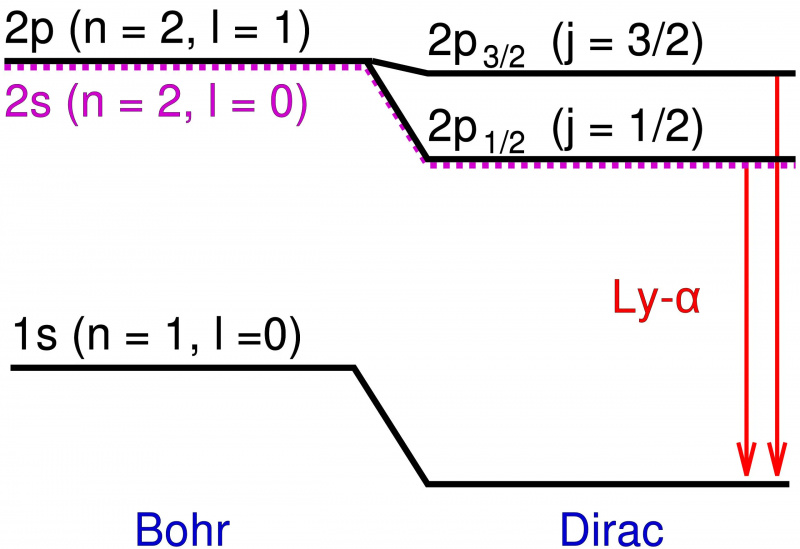 No modelo de Bohr do átomo de hidrogênio, apenas o momento angular em órbita do elétron pontual contribui para os níveis de energia. A adição de efeitos relativísticos e efeitos de rotação não apenas causa uma mudança nesses níveis de energia, mas também faz com que os níveis degenerados se dividam em vários estados, revelando a estrutura fina da matéria no topo da estrutura grosseira prevista por Bohr.
No modelo de Bohr do átomo de hidrogênio, apenas o momento angular em órbita do elétron pontual contribui para os níveis de energia. A adição de efeitos relativísticos e efeitos de rotação não apenas causa uma mudança nesses níveis de energia, mas também faz com que os níveis degenerados se dividam em vários estados, revelando a estrutura fina da matéria no topo da estrutura grosseira prevista por Bohr.Esses níveis de energia adicionais eram extremamente próximos um do outro e também muito próximos das previsões de Bohr. Mas as diferenças eram reais e, portanto, a tarefa dos físicos era explicar o que as causava.
A chave para a resposta está nas suposições que Bohr usou ao criar seu modelo: que os elétrons eram partículas carregadas e sem spin que orbitavam o núcleo atômico a velocidades significativamente menores que a velocidade da luz. Isso foi bom o suficiente para explicar a estrutura grosseira dos átomos, ou a natureza geral dos níveis de energia, mas não essa estrutura adicional, mais sutil.
Demorou apenas 4 anos para a primeira tentativa teórica de explicar isso acontecer, por meio do físico Arnold Sommerfeld. A grande descoberta de Sommerfeld foi esta: se você modelasse um átomo de hidrogênio usando o modelo simplista de Bohr, mas pegasse a razão da velocidade de um elétron no estado fundamental e comparasse com a velocidade da luz, você obteria um certo valor. Sommerfeld chamou esse valor a , que hoje conhecemos como constante de estrutura fina . Depois de colocá-lo nas equações de Bohr, você realmente descobriu que ele causou uma mudança nos níveis de energia observados, representando não apenas a estrutura grosseira de um átomo em termos de níveis de energia, mas essa 'estrutura fina' mais precisa, como ainda é chamada hoje. .
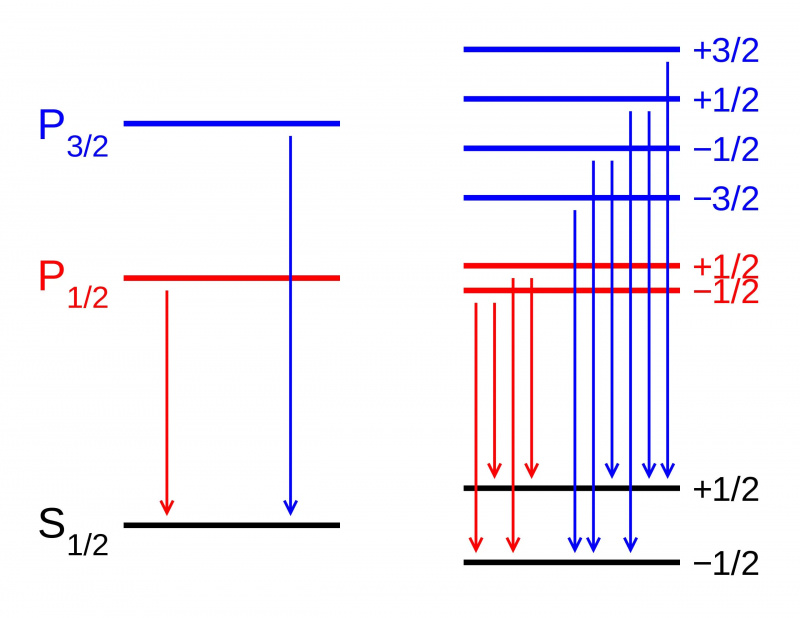 Na ausência de um campo magnético, os níveis de energia de vários estados dentro de um orbital atômico são idênticos (L). Porém, se um campo magnético for aplicado (R), os estados se dividem de acordo com o efeito Zeeman. Aqui vemos a divisão Zeeman de uma transição de dupleto P-S. Outros tipos de divisão ocorrem devido a interações spin-órbita, efeitos relativísticos e interações com o spin nuclear, levando à estrutura fina e hiperfina da matéria.
Na ausência de um campo magnético, os níveis de energia de vários estados dentro de um orbital atômico são idênticos (L). Porém, se um campo magnético for aplicado (R), os estados se dividem de acordo com o efeito Zeeman. Aqui vemos a divisão Zeeman de uma transição de dupleto P-S. Outros tipos de divisão ocorrem devido a interações spin-órbita, efeitos relativísticos e interações com o spin nuclear, levando à estrutura fina e hiperfina da matéria.Mas se você olhar mais intrincadamente para a estrutura dos átomos, descobrirá que mesmo com a explicação de Sommerfeld para o efeito do movimento dos elétrons, isso não explica tudo o que existe. Isso porque Sommerfeld explicou apenas o primeiro dos três principais efeitos que servem como correções de estrutura fina para o modelo grosseiro de Bohr.
- Elétrons e outras partículas quânticas podem ter velocidades que se aproximam da velocidade da luz.
- Os elétrons não têm apenas momento angular de suas órbitas ao redor do núcleo atômico, mas uma quantidade intrínseca de momento angular conhecido como spin, com um valor de ± h/2 ,
- e os elétrons também exibem um conjunto inerente de flutuações quânticas em seu movimento conhecido como movimento de agitação .
O segundo é de particular relevância, pois o spin do elétron, seja + h/2 ou - h/2 (positivo ou negativo em relação ao momento angular orbital do elétron), produzirá um momento magnético, e esse momento magnético interagirá, positiva ou negativamente, com o momento angular orbital do elétron.
Viaje pelo Universo com o astrofísico Ethan Siegel. Os assinantes receberão a newsletter todos os sábados. Todos a bordo!Mas podemos ir ainda mais fundo do que isso. Há um efeito ainda mais sutil do que a estrutura fina que surge em átomos e moléculas: estrutura hiperfina .
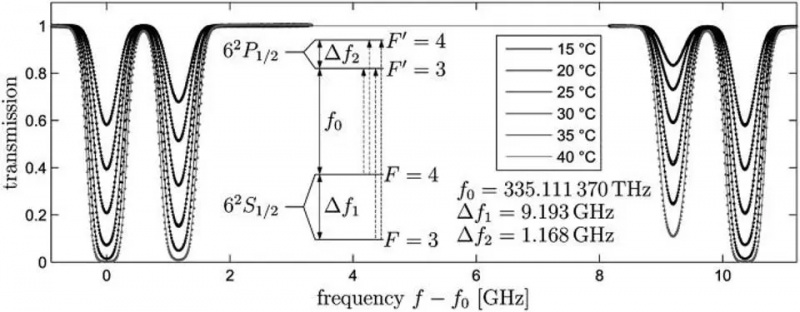 A transição atômica do orbital 6S em um átomo de césio-133, Delta_f1, é a transição que define o metro, o segundo e a velocidade da luz. Pequenas mudanças na frequência observada desta luz ocorrerão com base no movimento e nas propriedades da curvatura espacial entre quaisquer dois locais. As interações spin-órbita, bem como várias regras quânticas e a aplicação de um campo magnético externo, podem causar divisões adicionais em intervalos estreitos nesses níveis de energia: exemplos de estrutura fina e hiperfina.
A transição atômica do orbital 6S em um átomo de césio-133, Delta_f1, é a transição que define o metro, o segundo e a velocidade da luz. Pequenas mudanças na frequência observada desta luz ocorrerão com base no movimento e nas propriedades da curvatura espacial entre quaisquer dois locais. As interações spin-órbita, bem como várias regras quânticas e a aplicação de um campo magnético externo, podem causar divisões adicionais em intervalos estreitos nesses níveis de energia: exemplos de estrutura fina e hiperfina.Se os elétrons, partículas carregadas, têm um spin intrínseco e um momento magnético intrínseco, eles podem interagir com qualquer coisa que crie um campo magnético, incluindo:
- o núcleo atômico carregado e giratório,
- quaisquer assimetrias dentro do campo elétrico do próprio átomo,
- e, se esses elétrons estiverem em uma molécula em vez de um átomo monoatômico, a interação entre os momentos magnéticos dos diferentes núcleos atômicos e o campo magnético gerado pela rotação geral da molécula.
Qualquer interação eletromagnética entre partículas carregadas ou magnetizadas pode alterar os níveis de energia dentro de átomos e/ou moléculas, com o modelo original de Bohr fornecendo a estrutura geral grosseira, com movimentos de partículas, flutuações nesses movimentos e a interação spin-órbita fornecendo estrutura fina correções a essa estrutura grosseira e, em seguida, com interações mais sutis entre elétrons e efeitos eletromagnéticos internos e externos adicionais, fornecendo estrutura hiperfina sobre a estrutura grosseira e fina.
Tudo isso é necessário para explicar a estrutura dos níveis de energia dentro dos átomos e moléculas, e isso tudo antes mesmo de começarmos a considerar campos elétricos e magnéticos aplicados externamente.
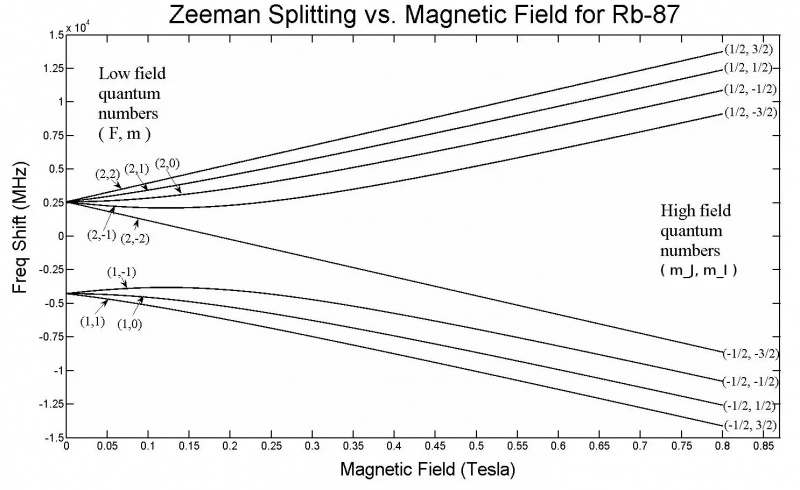 Este gráfico mostra a divisão de Zeeman nos orbitais 5s de um átomo de Rubídio-87. Observe que, à medida que a intensidade do campo aumenta, a quantidade de divisão também aumenta, dependendo de propriedades como os estados de spin quântico dos vários elétrons. O efeito Zeeman é geralmente muito menor do que o efeito Stark.
Este gráfico mostra a divisão de Zeeman nos orbitais 5s de um átomo de Rubídio-87. Observe que, à medida que a intensidade do campo aumenta, a quantidade de divisão também aumenta, dependendo de propriedades como os estados de spin quântico dos vários elétrons. O efeito Zeeman é geralmente muito menor do que o efeito Stark.Mas só com essa configuração já quase chegamos na solução! Se você aplicar um campo elétrico ou magnético externo a qualquer átomo ou molécula, esses níveis de energia também serão afetados pelo mesmo mecanismo: através da interação desses elétrons giratórios, orbitais, carregados e intrinsecamente magnéticos com esses campos. Só que desta vez há uma grande diferença: enquanto a estrutura hiperfina dentro dos átomos e moléculas sempre tem um efeito pequeno em comparação com os efeitos da estrutura fina, e os efeitos da estrutura fina são pequenos em comparação com a estrutura grosseira dos átomos, a magnitude da força elétrica aplicada e os campos magnéticos podem assumir qualquer valor, apenas limitados por nossas configurações de laboratório.
Isso significa que, se você aplicar um campo elétrico externo, ele interagirá com todos os diferentes componentes de seus átomos e moléculas, fazendo com que os níveis de energia dos elétrons dentro dos átomos se dividam ainda mais. Da mesma forma, se você aplicar um campo magnético externo, terá os mesmos efeitos: dividir os níveis de energia dos elétrons ainda mais do que antes. Embora, na maioria dos casos, esses efeitos simplesmente “cresçam” as divisões já induzidas pela estrutura fina e hiperfina dentro dos átomos, em alguns casos, podem até causar novas divisões adicionais nos níveis de energia: divisões que desaparecem completamente se o campo externo está desligado.
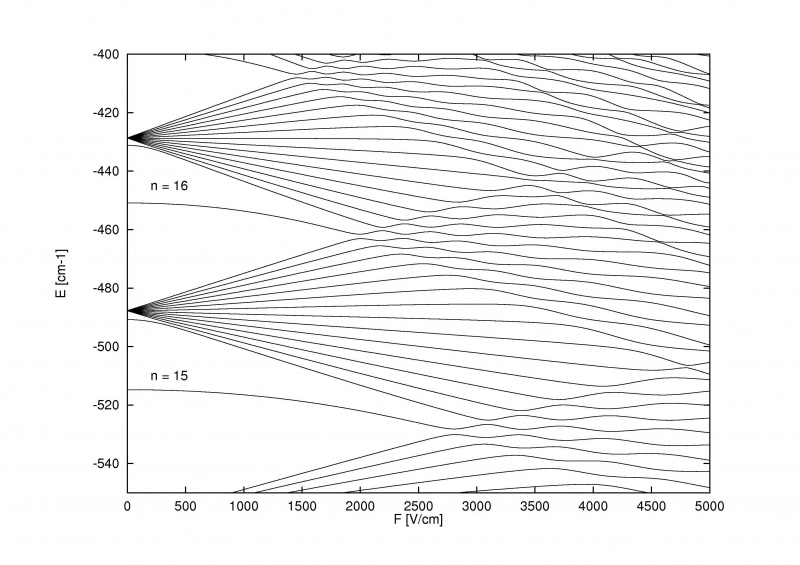 O efeito Stark, que divide os níveis de energia dentro dos átomos quando um campo elétrico externo é aplicado, pode ser tão forte que pode superar não apenas a divisão da estrutura fina e hiperfina dentro dos átomos e moléculas, mas também a própria estrutura grosseira de Bohr.
O efeito Stark, que divide os níveis de energia dentro dos átomos quando um campo elétrico externo é aplicado, pode ser tão forte que pode superar não apenas a divisão da estrutura fina e hiperfina dentro dos átomos e moléculas, mas também a própria estrutura grosseira de Bohr.O que é mais legal sobre o efeito Zeeman e o efeito Stark é que ambos são antigos: mais antigos do que a maior parte da história sobre estruturas finas e hiperfinas em átomos. Pieter Zeeman descobriu o efeito da divisão magnética de linhas espectrais em 1896, enquanto Johannes Stark descobriu o efeito de divisão elétrica análogo para linhas de emissão e absorção em 1913. Antes mesmo de reconhecermos que os elétrons tinham spin, que um spin-órbita interação estava ocorrendo, ou que os níveis de energia poderiam ser afetados por componentes magnéticos e elétricos dentro dos próprios átomos e moléculas, havíamos descoberto experimentalmente esses efeitos.
Muitas vezes, na física e em muitas outras ciências, as “descobertas” experimentais ou observacionais precedem em muito a explicação teórica que mais tarde acabamos descobrindo para elas. Em ambos os casos dos efeitos Zeeman e Stark, essas foram descobertas de vital importância no caminho para o desenvolvimento moderno da mecânica quântica, e receberam justamente prêmios Nobel, respectivamente, em 1902 e 1919 . Geralmente, o efeito Stark pode ser enorme e, portanto, a divisão da linha espectral, se você deseja “sintonizar” um átomo para absorver ou emitir em um determinado comprimento de onda, é controlada por campos magnéticos, em vez de elétricos. No entanto, a chave para criá-lo é aplicar seu campo ao átomo emissor ou absorvedor, não ao fóton, uma vez que já está em vôo!
Envie suas perguntas do Ask Ethan para começa com abang no gmail ponto com !
Compartilhar:
















