A entropia de um sistema fechado nem sempre aumenta
A segunda lei da termodinâmica é uma lei inviolável da realidade. Aqui está o que todos deveriam saber sobre sistemas fechados, abertos e isolados.- Talvez a lei mais inviolável de toda a realidade física seja a segunda lei da termodinâmica, que relaciona calor, trabalho e interconversões de energia dentro de um sistema.
- Embora esta fosse originalmente uma lei empírica, a ciência da mecânica estatística forneceu uma base sólida para a compreensão de como a segunda lei sustenta a realidade e por que a entropia de qualquer sistema isolado sempre aumenta.
- No entanto, muitos de nós aprendemos a segunda lei como “a entropia de um sistema fechado nunca pode diminuir”, e isso simplesmente não é verdade com base na nossa compreensão atual da termodinâmica. É aqui que surge a confusão e como acertar daqui em diante.
Imagine que você tem um copo no alto de um balcão e ele cai no chão. A física lhe diz o que vai acontecer: seu copo vai atingir o chão com uma velocidade específica e com uma certa quantidade calculável de energia cinética. Esse impacto pode facilmente resultar na quebra do vidro: um processo espontâneo que resulta da conversão de uma forma de energia em outras. No entanto, o processo inverso – de fragmentos de vidro estilhaçados remontando espontaneamente e jogando o vidro totalmente montado de volta no balcão – nunca ocorre espontaneamente. Isto pode ser simplesmente explicado por as leis da termodinâmica , e em especial pelo segunda lei .
Muitos de nós, especialmente nos Estados Unidos, aprendemos sobre a segunda lei em termos de entropia: uma propriedade física de todos os sistemas termodinâmicos. A segunda lei pode ser expressa em termos de:
- a eficiência máxima de um motor,
- a quantidade de trabalho útil que pode ser extraído de um sistema,
- o fluxo espontâneo de calor de fontes quentes para fontes frias (e nunca o processo inverso),
- ou pelo número de possíveis arranjos idênticos do estado quântico do seu sistema,
tudo de forma equivalente e correta. No entanto, uma das formas mais comuns de ensino tradicionalmente é dizer: “a entropia de um sistema fechado nunca aumenta”, e isso não é verdade. A entropia de um sistema isolado nunca aumenta, mas isolado é diferente de fechado, e aberto ainda é uma terceira condição ainda mais diferente. Aqui está o que todos deveriam saber sobre entropia, as leis da termodinâmica e os diferentes tipos de sistemas que existem.
 Se a 2ª lei da termodinâmica pudesse realmente ser violada, então as máquinas de movimento perpétuo seriam uma possibilidade fisicamente real. Na realidade, a 2ª lei deve ser sempre obedecida, por isso devemos ter cuidado para evitar contradições na definição das nossas expectativas para um sistema físico.
Se a 2ª lei da termodinâmica pudesse realmente ser violada, então as máquinas de movimento perpétuo seriam uma possibilidade fisicamente real. Na realidade, a 2ª lei deve ser sempre obedecida, por isso devemos ter cuidado para evitar contradições na definição das nossas expectativas para um sistema físico.Isolando um sistema
Sempre que você considera qualquer sistema físico, você sempre pode pensar em várias partes dele. Existem os componentes dentro do sistema que interagem de forma independente - como moléculas de gás voando dentro de uma caixa selada - e há componentes que são externos ao próprio sistema, mas que ainda podem interagir com o sistema de alguma forma fundamental. forma: geralmente chamado de “meio ambiente” ou algo semelhante.
Se considerarmos o sistema total, que inclui o sistema físico de interesse, bem como o ambiente externo circundante, este é o caso ideal para aplicar a segunda lei da termodinâmica. Ao considerar o sistema total, você está considerando:
- toda a energia que flui entre diferentes partes dele, sem nenhuma energia entrando ou saindo,
- todas as partículas que interagem dentro do sistema, sem que nenhuma partícula entre ou saia dele,
- a totalidade do volume do sistema, que não aumenta ou diminui em relação a algum ambiente externo ou limite,
- e todo o trabalho realizado por uma parte sobre outra, sem fontes externas ou sumidouros de trabalho.
Quando absolutamente tudo é contabilizado e nada se perde ou falta, você está lidando com o sistema total em sua totalidade.
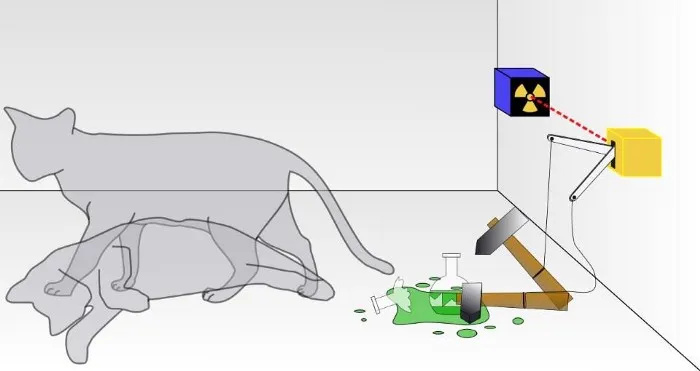 Numa experiência tradicional com o gato de Schrodinger, não se sabe se o resultado de uma decadência quântica ocorreu, levando à morte do gato ou não. Dentro da caixa, o gato estará vivo ou morto, dependendo se uma partícula radioativa decaiu ou não. Embora raramente seja discutido, a validade de uma experiência com o gato de Schrodinger depende do sistema estar isolado do seu ambiente; se o isolamento não for perfeito, a natureza quântica da superposição de estados será perturbada.
Numa experiência tradicional com o gato de Schrodinger, não se sabe se o resultado de uma decadência quântica ocorreu, levando à morte do gato ou não. Dentro da caixa, o gato estará vivo ou morto, dependendo se uma partícula radioativa decaiu ou não. Embora raramente seja discutido, a validade de uma experiência com o gato de Schrodinger depende do sistema estar isolado do seu ambiente; se o isolamento não for perfeito, a natureza quântica da superposição de estados será perturbada.Esta é uma tarefa difícil, claro: dar conta de cada partícula subatômica e de cada quantum de energia, e não permitir que nada de fora deste sistema o afete de forma alguma, nem permitir que nada de dentro deste sistema afete o exterior. ambiente de qualquer forma. (Para alguns que trabalham na área, eles observam que “o Universo” é o único sistema total verdadeiro, e mesmo isso é questionável porque o próprio Universo está em expansão.)
Embora seja um caso bastante idealizado, podemos considerar todos os aspectos de algo dentro de um sistema físico e tratá-lo como se nada de fora desse sistema - nenhum calor, nenhum trabalho, nenhuma energia, nenhuma partícula, etc. , e que, além disso, nada de dentro desse sistema afeta ou atua em seu ambiente externo.
Nessa situação ideal, você pode considerar seu sistema isolado.
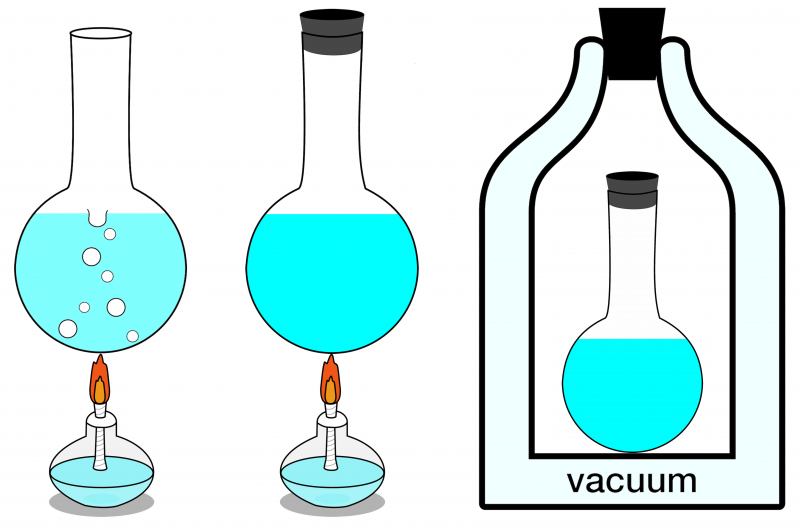 Dos três sistemas aqui mostrados, apenas o sistema mais à direita pode ser considerado isolado. Nenhuma energia pode entrar ou sair dela, e também nenhuma matéria entra ou sai dela. À esquerda, é mostrado um sistema aberto, onde matéria e energia podem ser trocadas com o meio ambiente, e no centro, é ilustrado um sistema fechado que permite a troca de energia (mas não de matéria).
Dos três sistemas aqui mostrados, apenas o sistema mais à direita pode ser considerado isolado. Nenhuma energia pode entrar ou sair dela, e também nenhuma matéria entra ou sai dela. À esquerda, é mostrado um sistema aberto, onde matéria e energia podem ser trocadas com o meio ambiente, e no centro, é ilustrado um sistema fechado que permite a troca de energia (mas não de matéria).Se o seu sistema isolado estiver em equilíbrio térmico, o que significa que não há
- troca ou transferência de calor,
- sem limites móveis para o sistema (um exemplo de trabalho),
- nenhuma entrada ou saída de partículas,
- sem transições químicas,
- sem bombeamento ou outras forças aplicadas,
- e que não existe um “estado de energia mais baixo” para o qual qualquer aspecto do sistema possa fazer a transição,
então a entropia total do seu sistema permanecerá constante e em seu valor máximo. Caso contrário, se houver partes do sistema que
- pode transferir ou trocar calor,
- pode transferir ou trocar partículas,
- pode expandir ou contrair,
- pode sofrer transições químicas,
- pode bombear em outra parte do sistema ou exercer forças internas,
- e/ou podem experimentar transições para estados de energia mais baixa,
então a entropia total do seu sistema aumentará com o tempo.
Isto é sempre verdade e é o cerne da segunda lei da termodinâmica: a entropia de um sistema isolado tenderá sempre para um valor máximo, e só depois de atingir o seu verdadeiro estado de equilíbrio, onde nenhuma das trocas mencionadas acima (ou qualquer outra tais mudanças não enumeradas especificamente aqui, como as transições nucleares) podem ocorrer, se a sua entropia deixar de aumentar: em vez disso, permanecerá constante a partir de então.
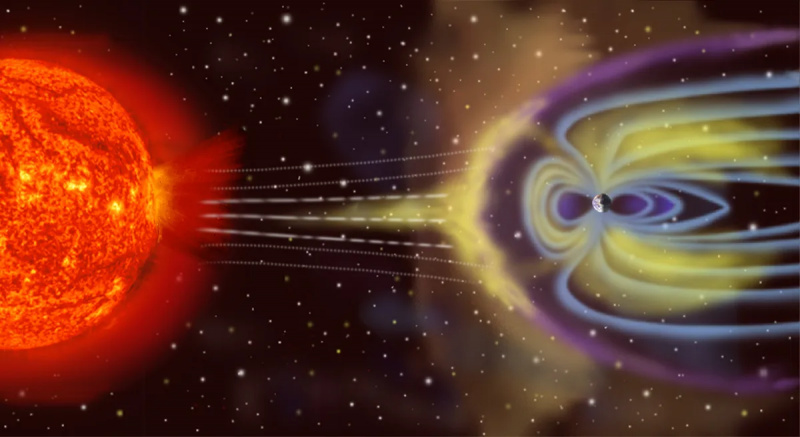 A Terra não é um sistema termodinâmico isolado, pois não só recebe energia do Sol e irradia energia de volta para o espaço, mas (em um pequeno nível) é impactada por asteróides, cometas, vento solar e partículas cósmicas, e também lança partículas atmosféricas no espaço ao longo do tempo.
A Terra não é um sistema termodinâmico isolado, pois não só recebe energia do Sol e irradia energia de volta para o espaço, mas (em um pequeno nível) é impactada por asteróides, cometas, vento solar e partículas cósmicas, e também lança partículas atmosféricas no espaço ao longo do tempo.O oposto de isolado
É claro que a marcha implacável da entropia pode ser combatida – vidros quebrados podem ser consertados, salas bagunçadas podem ser limpas e organizadas, e até mesmo leite quente pode ser resfriado e preservado – se você não tiver mais um sistema isolado, mas um onde o sistema externo influências podem afetar o sistema em questão. Isso normalmente assume duas formas:
- aquele em que a matéria real é transferida para dentro ou para fora do sistema, juntamente com calor, energia e também trocas de trabalho,
- e aquele em que nenhuma matéria pode entrar ou sair do sistema, embora a energia ainda possa ser transferida para dentro ou para fora e os limites da extensão física do sistema também possam mudar.
O primeiro deles oferece mais liberdade e é conhecido como sistema termodinamicamente aberto. Em um sistema aberto, a matéria pode entrar e sair dele, junto com a energia. Num sistema aberto, não só as paredes de um sistema podem expandir-se ou contrair-se, mas as paredes nem sequer são impermeáveis: a matéria pode entrar ou sair dele. Uma panela no fogão é um sistema aberto, pois a energia pode entrar nela (através do queimador abaixo dela) e a matéria pode sair (escapando para o ar acima dela), enquanto um forno holandês não está completamente aberto, pois a energia pode entra (através do queimador abaixo), mas nenhuma matéria pode sair, pois a parte superior selada confina qualquer matéria aquecida na fase gasosa.
 Uma panela no fogão, na parte inferior, representa um sistema termodinâmico aberto, pois a energia pode entrar no sistema por baixo e a matéria pode escapar do sistema por cima. Um forno holandês selado, no topo, representa um sistema termodinâmico fechado, pois a energia pode entrar, mas nenhuma matéria pode sair.
Uma panela no fogão, na parte inferior, representa um sistema termodinâmico aberto, pois a energia pode entrar no sistema por baixo e a matéria pode escapar do sistema por cima. Um forno holandês selado, no topo, representa um sistema termodinâmico fechado, pois a energia pode entrar, mas nenhuma matéria pode sair.O caso intermediário: o sistema fechado
Este é muito sorrateiro: e se você não permitir que a matéria entre ou saia, mas permitir que a energia e/ou o trabalho fluam, para dentro ou para fora do sistema, a partir do ambiente externo?
Isso é conhecido como sistema fechado: o caso intermediário entre aberto e isolado. Se algo está pingando em seu cérebro agora, dizendo “isso está errado, não foi isso que aprendi que é um sistema fechado”, então parabéns, você está no mesmo barco em que eu estava há apenas algumas semanas. (E sim, sou um físico PhD que estudou isso como parte do meu doutorado.)
Em alguns lugares – principalmente em cursos de física nos Estados Unidos – esta é uma nova distinção. Anteriormente, para muitos de nós, “fechado” era sinônimo do que definimos como “isolado”, acima. Na verdade, muitos de nós aprendemos, como uma versão abreviada da segunda lei da termodinâmica, “a entropia de um sistema fechado nunca pode diminuir”. E embora seja verdade que a entropia de um isolado sistema nunca pode diminuir, apenas aumentar ou permanecer o mesmo, a entropia de um sistema fechado pode diminuir muito: devido à entrada de trabalho ou energia, como ilustrado pelo famoso exemplo de O demônio de Maxwell .
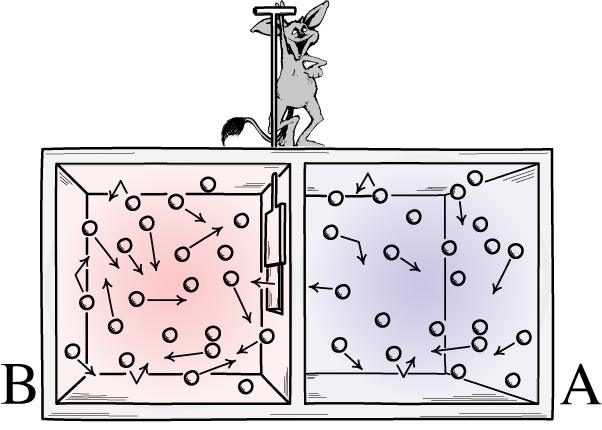 Esta ilustração mostra os dois lados de uma sala: um quente e outro frio, com um demônio entre eles capaz de abrir e fechar uma divisória entre eles. Se o divisor for aberto, os gases se misturarão; se os gases estivessem inicialmente bem misturados, o demônio abrindo e fechando a divisória poderia classificar a sala, mesmo para um sistema “fechado”.
Esta ilustração mostra os dois lados de uma sala: um quente e outro frio, com um demônio entre eles capaz de abrir e fechar uma divisória entre eles. Se o divisor for aberto, os gases se misturarão; se os gases estivessem inicialmente bem misturados, o demônio abrindo e fechando a divisória poderia classificar a sala, mesmo para um sistema “fechado”.O demônio de Maxwell era uma ideia que dizia considerar o sistema acima: de uma sala com uma divisória. Inicialmente, os gases em ambos os lados da sala são o que chamamos de “bem misturados”, o que significa que ambas as salas consistem em gás que é:
- composto do mesmo material em ambos os lados da divisória,
- à mesma temperatura em ambos os lados do divisor,
- com as mesmas densidades em ambos os lados do divisor,
- sem nenhum trabalho sendo feito nas paredes do contêiner, incluindo a divisória,
- e sem nenhuma transferência de energia ou calor ocorrendo preferencialmente em uma direção ou outra.
Mas imagine que há uma portinha na divisória que separa as duas seções da sala, e uma pequena criatura inteligente que odeia a 2ª lei da termodinâmica: um verdadeiro demônio de um personagem.
Agora imagine que esse demônio seja capaz de monitorar partículas, inclusive sempre que uma partícula tenta passar por uma porta na divisória. O próprio demônio está no controle da porta e a configura assim:
- Sempre que uma partícula “fria” tenta passar do lado direito para o esquerdo da sala, o demônio abre a porta, deixando-a (e somente ela) passar antes de fechá-la novamente.
- Sempre que uma partícula “quente” tenta passar do lado esquerdo para o direito da sala, o demônio abre a porta, deixando-a (e somente ela) passar antes de fechá-la novamente.
- E em todos os outros casos, a porta permanece fechada.
O que acontecerá com as partículas na sala, supondo que permitamos que o demônio faça o que quiser?
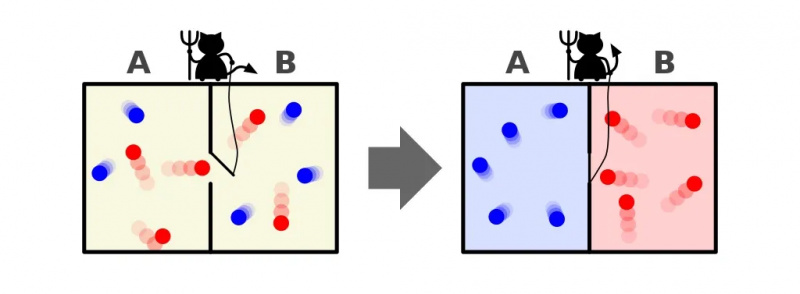 Uma representação do demônio de Maxwell, que pode classificar as partículas de acordo com sua energia em ambos os lados de uma caixa. Ao abrir e fechar a divisória entre os dois lados, o fluxo de partículas pode ser controlado de forma complexa, reduzindo a entropia do sistema dentro da caixa. No entanto, o demônio deve exercer energia para que isso aconteça, e a entropia geral do sistema caixa+demônio ainda aumenta.
Uma representação do demônio de Maxwell, que pode classificar as partículas de acordo com sua energia em ambos os lados de uma caixa. Ao abrir e fechar a divisória entre os dois lados, o fluxo de partículas pode ser controlado de forma complexa, reduzindo a entropia do sistema dentro da caixa. No entanto, o demônio deve exercer energia para que isso aconteça, e a entropia geral do sistema caixa+demônio ainda aumenta.A resposta, muito claramente, é que terminamos com um estado final que contém uma quantidade muito menor de entropia: com todas as partículas frias organizadas em um lado da divisória e com todas as partículas quentes classificadas no outro lado. da divisória, separados um do outro.
Violamos as leis da termodinâmica ao diminuir a entropia deste sistema fechado: um sistema que não permitia que a matéria entrasse ou saísse dele?
Não, porque permitimos que a energia fosse inserida no sistema: na forma do demônio abrindo e fechando a porta.
Na verdade, você pode diminuir a entropia de um sistema de várias maneiras, mesmo que seu sistema não esteja aberto, mas fechado. Você pode:
- energia de entrada em seu sistema,
- realizar trabalho nos limites do seu sistema,
- permitir transições químicas para liberar energia de dentro do seu sistema,
- bombeie seu sistema para criar um gradiente de temperatura,
- e, em geral, permitir a troca de energia entre o sistema e seu ambiente externo,
e ainda obedecer à segunda lei da termodinâmica. O truque é que o sistema em questão aqui é apenas fechado: não isolado.
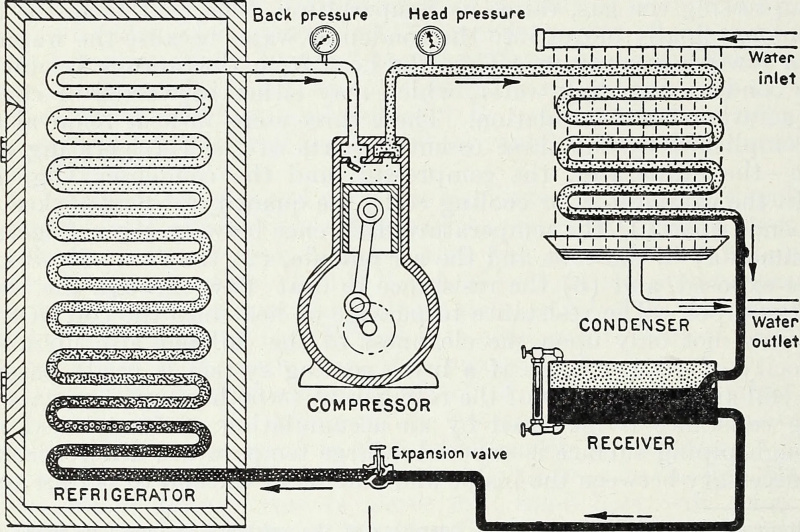 Através da entrada de energia e, especificamente, de energia de trabalho que comprime e rarefa os gases num sistema fechado, um reservatório frio pode tornar-se mais frio e uma fonte quente pode tornar-se mais quente. Este é o princípio termodinâmico fundamental por trás de uma bomba de calor e de um refrigerador, e é como a refrigeração moderna funciona até hoje.
Através da entrada de energia e, especificamente, de energia de trabalho que comprime e rarefa os gases num sistema fechado, um reservatório frio pode tornar-se mais frio e uma fonte quente pode tornar-se mais quente. Este é o princípio termodinâmico fundamental por trás de uma bomba de calor e de um refrigerador, e é como a refrigeração moderna funciona até hoje.Fechado vs. Isolado
Esta é a principal diferença que todos precisam saber. Num sistema verdadeiramente isolado, não há interação, fluxo ou troca de matéria ou energia entre o sistema que você está considerando e seu ambiente externo. Num sistema fechado, existem restrições quanto ao tipo de troca que ocorre, mas algum tipo de troca de energia ainda é permitido. Mesmo que sejam apenas as paredes do recipiente do seu sistema expandindo ou contraindo, isso ainda é uma interação com o ambiente, pois o trabalho (uma forma de energia) está sendo realizado nas paredes do recipiente, e esse trabalho (energia) então tem efeitos sobre a energia interna do sistema que está sendo considerado.
Viaje pelo Universo com o astrofísico Ethan Siegel. Os assinantes receberão a newsletter todos os sábados. Todos a bordo!A principal constatação que ajuda a colocar a segunda lei da termodinâmica de volta em ordem é esta: se você “ampliar” sua visão do que é o sistema físico em consideração, de modo que inclua tanto o “sistema fechado” que você estava examinando anteriormente quanto o ambiente externo em torno do sistema fechado, agora você está considerando o sistema total, e esse é um sistema isolado.
Em outras palavras, para fazer uma contabilidade adequada de toda a sua entropia, você precisa incluir as mudanças na entropia que também ocorrem em seu ambiente externo (anteriormente considerado). Se você fizer isso, descobrirá que a entropia total do seu sistema total (isolado) nunca pode diminuir: apenas aumentar ou permanecer a mesma, dependendo se está em equilíbrio térmico ou não.
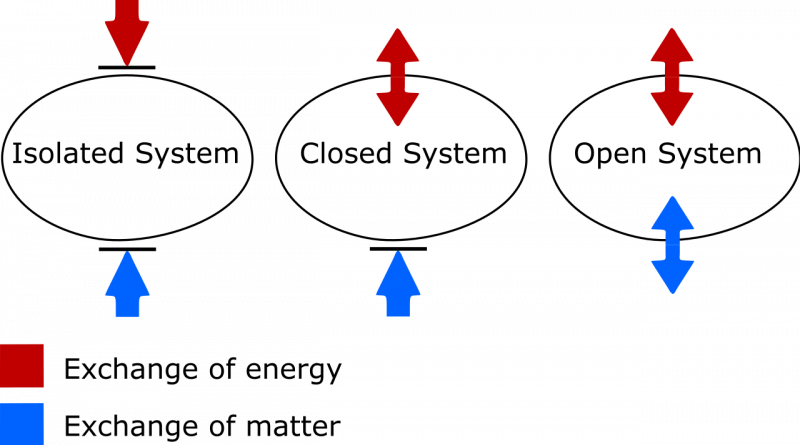 A diferença entre um sistema termodinâmico isolado, fechado e aberto. Num sistema isolado, nenhuma matéria ou energia é trocada entre o sistema e o ambiente, e a entropia nunca pode diminuir. Num sistema aberto, ambas as trocas são permitidas, enquanto que num sistema fechado, apenas a energia, e não a matéria, pode ser trocada com o ambiente. No caso de um sistema fechado e aberto, a entropia do sistema pode diminuir nas circunstâncias adequadas.
A diferença entre um sistema termodinâmico isolado, fechado e aberto. Num sistema isolado, nenhuma matéria ou energia é trocada entre o sistema e o ambiente, e a entropia nunca pode diminuir. Num sistema aberto, ambas as trocas são permitidas, enquanto que num sistema fechado, apenas a energia, e não a matéria, pode ser trocada com o ambiente. No caso de um sistema fechado e aberto, a entropia do sistema pode diminuir nas circunstâncias adequadas.Há duas coisas a serem observadas aqui. Uma delas é a importante distinção entre sistemas termodinâmicos isolados, fechados e abertos. Como alguém que precisa atualizar meu vocabulário, saiba que:
- Os sistemas isolados não permitem nenhuma troca de matéria ou energia de qualquer tipo com o ambiente, incluindo alterações induzidas pelo trabalho nos limites do seu sistema. A entropia nunca pode diminuir para um sistema isolado.
- Os sistemas abertos são gratuitos, permitindo a troca de matéria e energia entre o sistema e o ambiente, e a entropia pode, em princípio, assumir qualquer valor no estado final devido às trocas permitidas.
- Os sistemas fechados não permitem a troca de matéria/material entre o sistema e o ambiente, mas permitem a troca de energia e trabalho através da fronteira que separa o sistema do ambiente. A entropia pode ser diminuída, sob condições adequadas, com entrada suficiente de energia do meio ambiente. (E se você também considerar o ambiente externo em conjunto com o seu sistema fechado, poderá “promovê-lo” a um sistema isolado, para o qual a entropia nunca poderá diminuir.)
Embora existam muitos sistemas abertos que estão “aproximadamente” fechados quando se trata de matéria (os humanos comem, respiram e excretam matéria, mas estão aproximadamente fechados; os planetas perdem moléculas atmosféricas para o espaço e também recebem material através de impactos do espaço, mas são aproximadamente fechado), a distinção entre aberto, fechado e isolado é de suma importância quando se considera o comportamento de sistemas físicos reais. Na busca pela compreensão do Universo, é importante que todos sejamos capazes de compreender os termos que utilizamos quando falamos uns com os outros sobre estes conceitos. Para todos que aprenderam física da mesma forma que eu, é hora de atualizar nossos conhecimentos: um sistema fechado apenas proíbe a troca de matéria e, com a entrada adequada de energia, mesmo a entropia de um sistema fechado pode realmente diminuir!
Compartilhar:
















