Por que a água quente congela mais rápido que a fria?

Crédito da imagem: Karen Stray Nolting de Princeton Landing News.
É conhecido como o efeito Mpemba, e foi observado desde Aristóteles. Mas a água quente às vezes pode congelar mais rápido do que a fria, e a ciência do porquê está apenas começando a ser totalmente compreendida.
Tenho vivido em uma enxurrada de imagens, mas sairei em um quadro congelado. -Anthony Quinn
Todos vocês já viram a filmagem e ouviram falar do truque: jogue um pote de água fervente no ar e vê-lo se transformar em neve. (Supondo que você não queimar-se em vez disso .) A física por trás desse comportamento estranho é incrivelmente interessante e relacionada a o que acontece com a água no espaço , mas há um fenômeno ainda mais bizarro e contra-intuitivo por aí, como meu velho amigo de faculdade Ricardo pergunta:
Em algumas circunstâncias, a água mais quente pode congelar mais rápido do que a água mais fria. Por que é isso?
Isso é conhecido como o efeito Mpemba , e acredite ou não, é real .

Crédito da imagem Conheça Wilson / flickr.
O efeito recebeu o nome de um aluno da Tanzânia, Erasto Mpemba, que notou enquanto fazia sorvete com seus colegas que o leite quente congelava mais rápido que o leite frio. Embora esse tipo de efeito tenha sido observado muitas vezes historicamente, na superfície dificilmente faz sentido. Vamos pensar por quê.
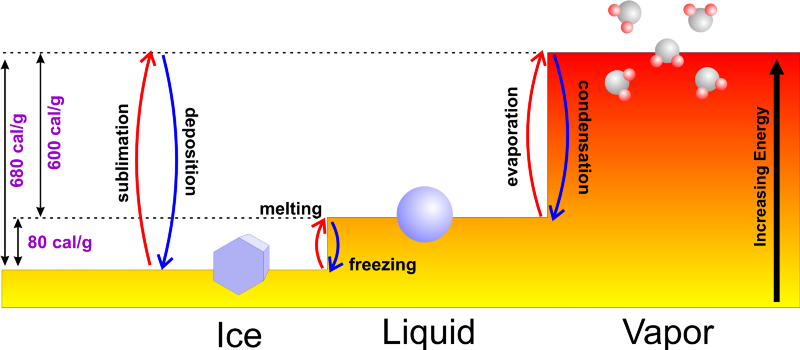
Crédito da imagem: Um mundo de clima: fundamentos da meteorologia .
Normalmente, se você começar com água líquida, você pode adicionar energia a ela, aquecendo-a até seu ponto de ebulição de 100 °C (212 °F) e continuando a adicionar energia à medida que ela passa por sua mudança de fase em vapor de água, ou você pode remover energia dele, resfriando até seu ponto de congelamento de 0 °C (32 °F) e continuando a remover o calor à medida que você o transforma em gelo. Só faria sentido se você começasse com água mais fria, congelaria mais rápido, pois levaria menos tempo para atingir o ponto de congelamento em primeiro lugar!
Na verdade, maioria experimentos que você pode fazer mostrarão exatamente isso: a água mais fria congela primeiro.
Crédito da imagem: picotech.com, recuperada de Douglas Clark em http://weeklysciencequiz.blogspot.com/2011/09/mpemba-effect.html .
Mesmo um experimento fracassado como esse, no entanto, oferece uma pista de como a água quente poder congelar mais rápido que o frio: observe como a água quente esfria mais rápido do que a fria! Novamente, isso é muito intuitivo, pois se você colocar uma panela de água a 10 °C e uma panela de água a 90 °C em ambientes de -10 °C, aquela com a diferença de temperatura de 100 °C perderá muito mais calor rapidamente do que com apenas 20 °C de diferença.
Mas há um pouco mais na história do que isso, e tem tudo a ver com as propriedades únicas da água .

Crédito da imagem: Simplebooklet, via http://simplebooklet.com/publish.php?wpKey=m2w0ULHgGA4y0coQhrdUVI#wpKey=m2w0ULHgGA4y0coQhrdUVI#page=1 .
Você vê, a água é muito polar molécula, com um átomo de oxigênio extremamente eletronegativo ligado a dois hidrogênios. Em química, cada oxigênio é um elétron hog, o que significa que a porção da molécula é geralmente carregada negativamente, enquanto o lado do hidrogênio é deficiente em elétrons, deixando-o carregado positivamente.
E se você pegar moléculas com extremidades negativas e positivas e juntar um monte delas, elas vão formar ligações soltas umas com as outras; isso é conhecido como ligação de hidrogênio .
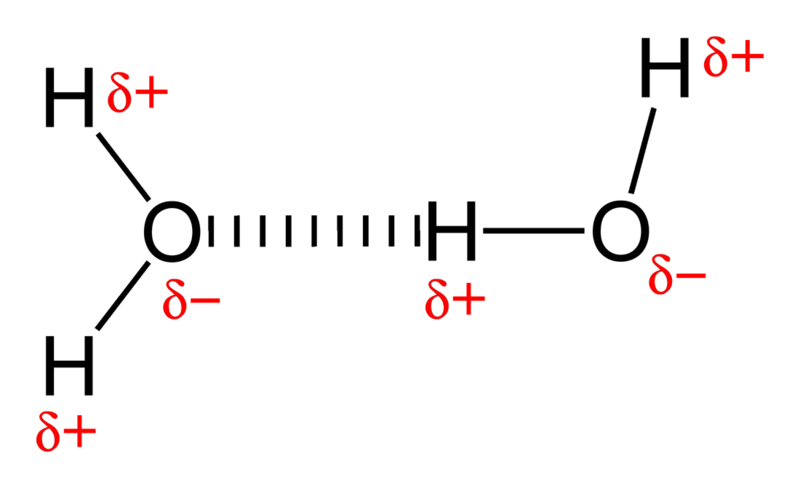
Crédito da imagem: usuário do Wikimedia commons Benjah-bmm27 .
Agora, na fase líquida, as moléculas de água estão livres para girar e se mover, muito mais do que na fase sólida, mas não tanto quanto na fase gasosa. Mas o que você acha que acontece quando você tem quente água versus resfriado agua?
Você provavelmente está familiarizado com esse experimento infantil: jogar corante alimentar em água quente e água fria.
O mais quente a água é, o mais rápido as moléculas individuais podem correr e se dispersar. O que está acontecendo em nível molecular é que quanto mais quente qualquer substância é:
- quanto mais rápido suas moléculas se movem,
- a mais fácil é quebrar espontaneamente essas tênues ligações de hidrogênio intermoleculares, e
- quanto mais ligações covalentes em cada molécula alongar.
Pelo menos, essas três coisas são o que normalmente acontece para uma substância líquida. Mas a água é apenas um pouco incomum .
Crédito de imagem: Brooklyn College, CUNY, via http://academic.brooklyn.cuny.edu/biology/bio4fv/page/polar_c.htm .
O engraçado disso é que em temperaturas frias (baixas), cada molécula de água normalmente tem pelo menos quatro moléculas de água vizinhas, cada uma puxando essa molécula altamente polar. Essas moléculas vizinhas – mesmo com suas fracas ligações de hidrogênio – efetivamente esticam as ligações covalentes entre os átomos de hidrogênio e oxigênio.

Crédito da imagem: usuário qwerter na Wikipédia checa.
Essa estrutura aproximadamente tetraédrica em torno de cada molécula de água é altamente interrompida em água mais quente, o que significa que não há mais esse alongamento intermolecular acontecendo. Assim, enquanto as moléculas de água está movendo-se mais rápido, e é mais fácil para quebrar essas tênues ligações de hidrogênio, as ligações covalentes dentro de cada molécula de água realmente encolher à medida que aumentam de temperatura!
Então, das três coisas padrão que tipicamente acontecem para líquidos, dois acontecem para água, mas o oposto acontece para o terceiro! Então, para água quente, essas ligações covalentes são mais curtas e mais rígidas, e quando você a resfria, contraindo as ligações de hidrogênio, isso forças as ligações covalentes para alongar, o que significa um tempo de relaxamento mais rápido e - sob as condições certas - um chegada mais rápida ao ponto de congelamento para inicialmente mais quente agua!

Crédito da imagem: Xi Zhang Yongli Huang, Zengsheng Ma e Chang Q Sun (2013), via http://arxiv.org/abs/1310.6514 .
Quanto mais alta a temperatura em que a água começa, mais energia é armazenada nessas ligações covalentes mais curtas e mais rígidas, e então colocar essa água em um ambiente muito frio faz com que a energia seja liberada a uma taxa que é exponencialmente depende da energia de ligação inicial!
(Abaixo, à esquerda, você pode ver como τ, a escala de tempo de liberação de energia, é muito menor em temperaturas iniciais mais altas e, à direita, você pode ver como a energia da ligação covalente é maior em temperaturas iniciais mais altas.)
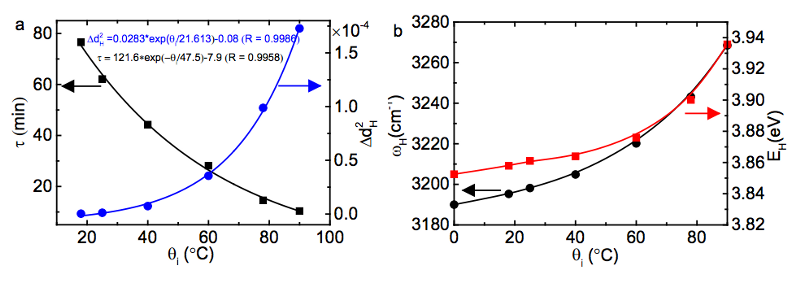
Crédito da imagem: Xi Zhang Yongli Huang, Zengsheng Ma e Chang Q Sun (2013), via http://arxiv.org/abs/1310.6514 .
Experimentalmente, a melhor maneira de reproduzir esse resultado é ter quantidades relativamente pequenas de água fria e água quase fervendo como seus assuntos iniciais, e um ambiente frio que não é também muito mais frio do que congelante, mas é grande o suficiente para não ser afetado pelo calor da água líquida.
E aquele é nosso entendimento atual de por que o efeito Mpemba acontece, ou por que inicialmente água mais quente pode congelar mais rápido do que fria!
Compartilhar:
















